1 de febrero de 2020 Volumen 106, Número 2, páginas 422″“429
Generación de luz de Cherenkov observada experimentalmente en el ojo durante la radioterapia
Irwin I. Tendler, MEng ∗
Alan Hartford, MD, PhD » , «¡
Michael Jermyn, PhD ∗, §
Ethan LaRochelle, BS ∗
Xu Cao, PhD ∗
Victor Borza, BS ∗
Daniel Alexander, MS ∗
Petr Bruza, PhD ∗
Jack Hoopes, PhD, DVM «¡, «–
Karen Moodie, DVM «¡
Brian P. Marr, MD¶
Benjamin B. Williams, PhD » , «¡
Brian W. Pogue, PhD ∗, §, «–
David J. Gladstone, ScD ∗, » , «¡
Lesley A. Jarvis, MD, PhD » , «¡, ∗, Información de correspondencia sobre el autor MD, PhD Lesley A. Jarvis Enviar un correo electrónico al autor MD, PhD Lesley A. Jarvis
Acceso abierto
Métricas PlumX
DOI: https://doi.org/10.1016/j.ijrobp.2019.10.031
Información del artículo
«¢ Resumen
«¢ Texto completo
«¢ Imágenes
«¢ referencias
«¢ Materiales suplementarios
Audio Video
«¢ 1
«¢ 2
Download File (2,66 MB)
Video 1
Emisión de luz de un ojo de cerdo enucleado, cuando se irradia con láminas de radiación desde varias direcciones y ángulos de pórtico
Esquema del artículo
I. Introducción
II Métodos y materiales
A. Experimentos oculares con animales
1. Espectros de emisión de luz y fuerza de señal
2. Dependencia angular
B. Imágenes del paciente
III. Resultados
A. Experimentos oculares con animales
1. Espectros de emisión de luz y fuerza de señal
2. Dependencia angular
B. Imágenes del paciente
IV. Discusión
V. Conclusiones
VI. Dato suplementario
VII. Referencias
Propósito
Los pacientes han informado sensaciones de ver destellos de luz durante la radioterapia, incluso con los ojos cerrados. Estas observaciones se han atribuido a la excitación directa de pigmentos retinianos o a la generación de luz de Cherenkov dentro del ojo. Se utilizaron imágenes de ojo humano in vivo y animal vivo para confirmar la intensidad de la luz y los espectros para determinar su origen y observabilidad general.
Métodos y materiales
Se usó una cámara de tiempo intensificado para capturar la luz que sale del ojo de un paciente sometido a radiocirugía estereotáctica en tiempo real, verificando así la detectabilidad de la luz a través de la pupila. Estos datos se compararon con imágenes mecanísticas de seguimiento de ojos de animales ex vivo con haces de radiación finos para evaluar los espectros de emisión y la variación de la intensidad de la señal con la profundidad anatómica. También se midió la dependencia angular de la emisión de luz del ojo.
Resultados
Las imágenes de los pacientes mostraron que la generación de luz en el ojo durante la radioterapia se puede capturar con una relación señal/ruido de 68. La irradiación de muestras oculares ex vivo confirmó que el espectro coincidía con el de la emisión de Cherenkov y que la intensidad de la señal era en gran medida homogénea en todo el ojo completo, desde la córnea hasta la retina, con un ligero máximo cercano a los 10 mm de profundidad. La observación de la señal externa al ojo fue posible a través de la pupila de 0° a 90°, con una emisión detectada cerca de 2500 fotones por milisegundo (durante la emisión máxima del ciclo ON del suministro pulsado), que es de más de 2 órdenes de magnitud más alto que el umbral de detección visible.
Conclusiones
Al cuantificar los espectros y la magnitud de la señal, ahora tenemos observaciones experimentales directas de que la luz de Cherenkov se genera en el ojo durante la radioterapia y puede contribuir a los destellos de luz percibidos. Además, esta técnica se puede utilizar para seguir estudiando y midiendo fosfenos en la clínica de radioterapia.
+
Resumen
Introducción
Los fosfenos son fenómenos de luz visual experimentados cuando no hay luz aparente que estimule el ojo. Pueden ser inducidos por estimulación mecánica (presión directa al ojo), electrónica (estimulación con electrodos del cerebro) y magnética (transcraneal) .1, 2, 3, 4 Las radiografías también pueden inducir fosfenos; Esto se hizo históricamente notable cuando los astronautas del Apolo informaron «destellos de luz» durante el vuelo translunar.5 El modelado teórico y las pruebas en voluntarios humanos en la década de 1970 sugirieron que estas sensaciones de luz eran probablemente el resultado de la activación directa de fotorreceptores retinianos o neuronas de la vía visual por radiación ionizante. Algunos informes también sugirieron que los radicales libres inducidos por la radiación cerca de los fotorreceptores de la retina pueden causar peroxidación lipídica y quimioluminiscencia que conducen a la creación de fotones bioluminiscentes.7 Sin embargo, una hipótesis alternativa de que los fosfenos resultaron de la producción directa de luz de Cherenkov en el humor vítreo o la retina del también se ha sugerido el ojo.8 Se han informado revisiones detalladas de los mecanismos subyacentes a los fosfenos inducidos por la radioterapia.9, 10, 11 Específicamente, se ha afirmado que la generación de luz de Cherenkov en el ojo es el mecanismo dominante responsable de los fosfenos percibidos durante el electrón. y radioterapia con fotones9,12, 13 A pesar de esta diversidad de posibles causas, ha habido poca medición mecanicista directa de este fenómeno.
La luz de Cherenkov se genera cuando una partícula cargada viaja a través de un medio dieléctrico (cargado) y su velocidad de fase excede la de la luz; se crea un «boom fotónico» de luz. Se pueden observar ejemplos de este fenómeno cuando los productos de fisión se descomponen en las piscinas de agua de los reactores nucleares o cuando los rayos cósmicos de alta energía interactúan con la atmósfera de la Tierra.14,15 Los modelos cuantitativos han demostrado que la luz de Cherenkov también se puede generar dentro del ojo humano cuando la radiación ionizante transecta el humor vítreo; la retina actúa como un sensor de luz, y el cerebro puede, a su vez, percibir la emisión de Cherenkov creada dentro del ojo.13 Los astronautas en el espacio, así como los pacientes con cáncer sometidos a radioterapia, informaron haber visto destellos azules de luz cuando se encontraban altos -radiación energética.16
El estudio completado aquí proporciona la primera evidencia directa de que los fosfenos inducidos por rayos X percibidos resultan, al menos en parte, de la producción de emisión de luz de Cherenkov. Usando una cámara de video intensificada y con temporizador, detectamos emisiones de luz de Cherenkov a través del ojo que coinciden con la administración de fotones de haz externo, mientras que el paciente observó simultáneamente fenómenos de luz visual. Además, la magnitud y el perfil espectral de la emisión de luz observada a partir de ojos animales ex vivo se midieron cuando el haz se localizó a profundidades anatómicas específicas. Los datos y la metodología descritos en este estudio proporcionan un medio directo para explorar el fenómeno de la producción de fosfeno inducido por la radiación y son especialmente útiles para observar este fenómeno en el marco de la radiocirugía estereotáctica y, en general, la radioterapia cerebral.
Métodos y materiales
Se usó un acelerador lineal Varian TrueBeam (Varian Medical Systems, Palo Alto, CA) para irradiar muestras de animales y pacientes. Se utilizó una cámara semiconductora complementaria de óxido de metal intensificado con C-Dose (DoseOptics, Lebanon, NH) para obtener imágenes de emisión de luz. Para mejorar la detección de la señal de Cherenkov mientras se suprime simultáneamente la luz ambiental, la adquisición de imágenes se activó por tiempo a pulsos de acelerador lineal. La cámara se activó de forma inalámbrica utilizando una unidad de activación remota.17 Todas las imágenes se sustrajeron del fondo en línea, se filtraron la mediana espacial (tamaño de la ventana de 5 × 5 píxeles) y la mediana temporal (tamaño de la ventana de 5 imágenes), y se corrigió el campo oscuro y el campo plano; Todas las sesiones de imágenes se realizaron con las luces de la sala encendidas. Las especificaciones del flujo de trabajo de procesamiento de imágenes y el mecanismo de activación se han descrito previamente18, 19, 20, 21, 22. Los datos de imagen se transmitieron a través de un cable de fibra óptica desde la cámara a una computadora fuera de la bóveda del acelerador lineal para el procesamiento de imágenes.20 Salida de la cámara (mapas de intensidad de 1600 × 1200 píxeles, formato .raw) se procesó para visualización en tiempo real utilizando el software CDose (DoseOptics); Además, MATLAB (MathWorks, Natick, MA) se utilizó para el análisis y procesamiento de imágenes. Los tejidos animales utilizados durante los experimentos ex vivo se obtuvieron a través de un proveedor comercial, y la Junta de Revisión Interna de Salud de Dartmouth-Hitchcock aprobó los estudios de imágenes en humanos. Se obtuvo el consentimiento informado de los pacientes.
Experimentos con ojos de animales
Ojos porcinos enteros fueron cosechados el mismo día de la imagen; Las muestras se mantuvieron frescas (no congeladas) en hielo durante el transporte (Sierra Medical Inc, Whittier, CA). Las muestras se limpiaron quirúrgicamente para eliminar la grasa adherida, el tejido conectivo y la postnucleación muscular restante. Los ojos se colocaron en el isocentro de la plataforma de tratamiento con acelerador lineal y se irradiaron con el pórtico a 180° (dirección de arriba hacia abajo).
Espectros de emisión de luz y fuerza de señal
El ojo se colocó en un soporte impreso en 3D personalizado (ácido poliláctico, recubierto con pintura negra mate) (Entropic Industries, Endwell, NY). La muestra se irradió a intervalos repetidos utilizando una «lámina» de radiación plana de 6 MV de 1 × 50 mm (ancho × largo), generada utilizando colimadores de múltiples capas con las mandíbulas completamente abiertas, de arriba hacia abajo. Inicialmente, el isocentro de este campo de radiación plano se colocó en el centro del ojo, y luego el plano de irradiación se desplazó de forma incremental anterior y posterior a lo largo del eje de la muestra de ojo porcino con un tamaño de paso de 0.3 mm (un total de 100 pasos resultando en una longitud de escaneo de 30 mm).
Se conectó un PiMax3 (Princeton Instruments, Acton, MA) a un espectrógrafo SpectraPro 2300i (Acton Research Corporation, Princeton Instruments) para obtener perfiles espectrales de emisión de luz a partir de muestras oculares. El espectrómetro se calibró para tener en cuenta la intensidad y la sensibilidad de detección espectral siguiendo los métodos descritos anteriormente.23 Se usó un tiempo de exposición de 10 milisegundos para obtener 20 cuadros con una ganancia de 100 ×. Se colocó una fibra de 1300 mm compuesta de fibras de 19 × 299 μm de diámetro (CeramOptek, Bonn, Alemania) a 10 mm de la cara frontal del ojo. La Figura 1A proporciona una ilustración de la configuración experimental. Se utilizaron una densidad de rejilla y un brillo de 150 g/mm y 500 nm, respectivamente. El fondo y las señales nativas se recogieron registrando datos con el haz de radiación apagado e irradiando solo la fibra, respectivamente. Estos espectros se restaron de los datos, y luego se utilizó un filtro Savitzky-Golay para producir el conjunto de datos final.
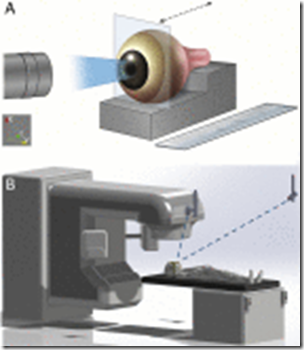
(A) Configuración experimental para la medición de espectros de emisión de luz. Se colocó un ojo de cerdo enucleado en un soporte tridimensional personalizado (caja escalonada gris) y se escaneó una lámina de radiación (fotones de 6 MV), 1 mm de ancho × 50 mm de longitud (cuadrado gris claro) a lo largo de la muestra . Para el análisis espectral, se colocó una sonda óptica directamente a 10 mm de la cara frontal del ojo. Para las imágenes de emisión, se colocó una cámara C-Dose en un trípode a 1500 mm del frente del ojo. Las dimensiones de la regla (cm) se dibujan a escala. (B) Ilustración que muestra la configuración de imagen dentro de la bóveda de tratamiento del acelerador lineal. El paciente fue asegurado al sofá utilizando un marco estereotáctico de radiocirugía inmovilizante. Se montaron dos cámaras en el techo a lo largo del costado (cerca del pie) del sillón de tratamiento, tanto en el lado izquierdo como en el derecho del paciente.
View Large Image | View Hi-Res Image | Download PowerPoint Slide
Se usó una técnica de radiación idéntica durante las investigaciones de perfil espectral para determinar la magnitud de la emisión de luz en función de la profundidad de irradiación dentro del ojo. La cámara se colocó a 1,5 m de distancia sobre un trípode con ruedas, y su altura se ajustó para que el ojo se centrase en el campo de visión. A medida que se irradiaba el ojo, se capturaron 1000 cuadros de imagen a 10 cuadros por segundo (fps) con una lente Rokinon 135 mm f / 2.0 ED UMC (Elite Brands Inc, Nueva York, NY). En las imágenes resultantes, se seleccionó para el análisis una región de interés circular de 10 mm de diámetro (ROI) en el área de la lente, y se calculó la intensidad media de píxeles por cuadro. La curva resultante se suavizó utilizando un filtro de media móvil.
Dependencia angular
Se exploró la dependencia angular de la emisión de Cherenkov del ojo. Las muestras oculares porcinas se colocaron en el centro de un haz de 6 MV cuadrado (50 mm x 50 mm) y se irradiaron en el isocentro. El ojo y la cámara se configuraron en la misma geometría que el experimento de intensidad de señal de emisión de luz descrito anteriormente. El ángulo entre la muestra y la cámara se cambió de 0° a 90° cambiando la cámara gradualmente, con imágenes (200 cuadros a 10 fps por ángulo) capturadas cada 10°. A lo largo del experimento, el ojo permaneció estacionario y se irradió con 100 MU en cada ángulo.
Imágenes del paciente
Un paciente sometido a radiocirugía estereotáctica por un meningioma recurrente adyacente a la órbita se sometió a imágenes durante el tratamiento. Después de la simulación y la planificación del tratamiento, el paciente se colocó en el sillón acelerador lineal, la cabeza se inmovilizó con un marco quirúrgico estereotáctico (Varian Medical Systems) y el volumen objetivo se trató con una dosis total de 18,0 Gy con filtro de aplanamiento. 10 fotones de MV gratuitos suministrados con radiocirugía estereotáctica guiada por imágenes de intensidad modulada.24 Un par de cámaras C-Dose (DoseOptics) montadas en el techo, idénticas a las utilizadas durante los experimentos con animales, fotografiaron al paciente durante el tratamiento real. Las cámaras se ubicaron a 2500 mm del isocentro acelerador lineal, y la emisión de luz se capturó en tiempo real simultáneamente a 14 fps usando ambas cámaras acopladas a una lente Nikon 50/50 f f / 2.8 AF (Nikon Inc, Tokio, Japón). La Figura 1B proporciona una ilustración de la configuración de imagen del paciente.
Solo se utilizaron mapas de intensidad de Cherenkov de la cámara ubicada en el lado izquierdo del paciente para el análisis de datos porque el pórtico obstruyó la vista del lado derecho del paciente durante una gran parte del tratamiento de radiación. Inmediatamente después del tratamiento, se entrevistó al paciente con respecto a los epifenómenos perceptuales. Los planes para las imágenes de Cherenkov no tuvieron impacto en la planificación del tratamiento de radiación; específicamente, la irradiación del ojo no era el objetivo principal del tratamiento; esto ocurrió independientemente en el curso de la optimización del plan para irradiar el tumor objetivo y preservar al máximo los tejidos normales vecinos.
Resultados
Experimentos con ojos de animales
Espectros de emisión de luz y fuerza de señal
La Figura 2 (panel superior) muestra que la fuerza de emisión fue 5 veces mayor con la irradiación de todo el ojo en comparación con el tratamiento con una lámina de radiación colocada a una profundidad de 5 a 10 mm. Al normalizar los resultados de la Figura 2A, los perfiles espectrales se vuelven más claros. Los espectros de emisión de luz del ojo permanecieron prácticamente sin cambios a medida que la hoja se escaneaba en toda la profundidad del ojo. Sin embargo, el patrón de emisión de Cherenkov ya no estaba presente después de la irradiación, posterior al ojo, en la región del nervio óptico. En el rango de 550 a 700 nm, los espectros se parecían a los de la emisión de Cherenkov previamente observada en Intralipid al 1% v / v (medido y simulado Monte Carlo), un fantasma de la cabeza que imita el tejido y una solución de Intralipid + al 1% v / v 1% v / v de sangre porcina completa (Fig. 2B) .25, 26, 27 Todos los espectros presentados en la Figura 2B fueron en promedio 25 ± 20% similares; La similitud se calculó calculando la integral aproximada utilizando el método trapezoidal.
(A) Gráficos de espectros de emisión de luz que sale de la muestra del ojo porcino. El ojo completo corresponde al haz de radiación cuadrado que abarca todo el ojo. Los valores de profundidad representan el grosor del ojo que se irradia; el frente del ojo es equivalente a una profundidad de 0 mm. La fila inferior es una normalización de la fila superior de datos. Los datos se muestran como recuentos y recuentos normalizados versus longitud de onda, respectivamente. (B) Los espectros de emisión de la irradiación del ojo completo, 1% v / v de Intralipid (medido y simulado Monte Carlo), un fantasma de la cabeza que imita los tejidos, y 1% v / v Intralipid + 1% v / v de sangre de cerdo entera. 25, 26, 27 Los espectros se normalizaron a emisión a 550 nm y se presentaron en el rango de 550 a 700 nm.
View Large Image | View Hi-Res Image | Download PowerPoint Slide
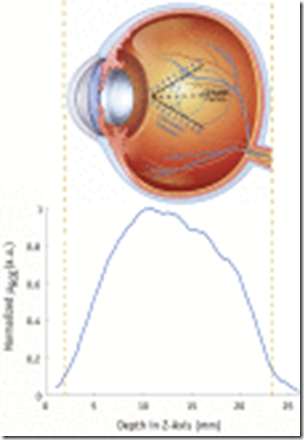
Considerando un eje de coordenadas tridimensional donde el plano X «“ Y corresponde a la cara frontal del ojo y Z se relaciona con la profundidad dentro del ojo, se puede ver cómo varía la emisión de luz a medida que se escanea la lámina de radiación a través del plano X «“ Y a lo largo el eje Z El Video 1 muestra la emisión de luz del ojo a medida que se irradia con láminas de radiación desde varias direcciones y ángulos de pórtico. En la Figura 3 se muestra una gráfica de la intensidad media de píxeles dentro de un ROI en la lente versus la profundidad del escaneo de la lámina de radiación. ojo). La irradiación fuera del ojo, tanto por delante de la lente como por detrás del ojo en la región del nervio óptico, produjo una intensidad de señal de <10% de la intensidad máxima.
Gráfico de la intensidad media normalizada en la región de interés de la lente versus la profundidad de la exploración de la lámina de radiación (profundidad en el eje z).
View Large Image | View Hi-Res Image | Download PowerPoint Slide
Dependencia angular
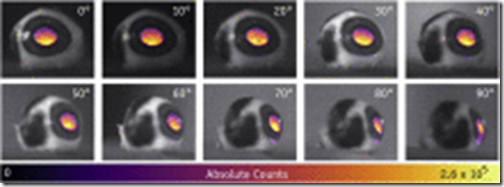
A medida que se cambió el ángulo de observación de la cámara y la posición del ojo y el haz de radiación cuadrado entrante se mantuvieron constantes, la intensidad promedio de píxeles dentro del ROI de la lente disminuyó en un 40%. La intensidad máxima de la señal en el ROI disminuyó en un 10% en el rango de ángulos probados. Además, estas imágenes muestran un efecto de dosis profunda dentro del volumen del ojo, explicando la distribución de la intensidad de píxeles que se ve en la Figura 4. Los valores de intensidad de píxeles sin procesar se calibraron para la radiación fotónica promedio (32 recuentos = 1 fotón) utilizando un láser de 635 nm fuente y sensor de potencia de fotodiodo estándar S120C (Thorlabs, Newton, NJ) siguiendo la metodología descrita previamente.28 Para el ROI utilizado en la imagen de 0° en la Figura 4, se detectaron 1.62 × 108 recuentos sumados, traduciéndose a 8.13 × 106 recuentos sumados por cuadro. A 10 fps, se midió que el número total de fotones que salen del ojo era de 8.13 × 103 fotones por 0,001 segundos durante la emisión máxima del ciclo ON del suministro pulsado.
Dependencia angular de la emisión de luz de Cherenkov de un ojo porcino. El número en la esquina superior derecha de cada panel representa el ángulo del ojo de la cámara.
View Large Image | View Hi-Res Image | Download PowerPoint Slide
Imágenes del paciente
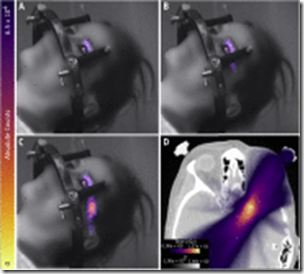
Una visualización del volumen de dosis acumulado planificado (mostrado en color) se superpuso en las tomografías computarizadas (mostradas en escala de grises) del paciente. En la Figura 5D se muestra un corte de muestra de esta representación (profundidad de 112.5 mm desde la parte superior de la cabeza). Se puede ver claramente que la trayectoria del haz transecta directamente el ojo izquierdo y el humor vítreo.
(A-C) Imágenes acumulativas de la emisión de Cherenkov obtenidas con el tiempo durante el tratamiento del paciente. (D) Corte de muestra (profundidad = 112.5 mm desde la parte superior de la cabeza) del volumen de dosis acumulada planificada tridimensional que se muestra en la exploración por tomografía computarizada. La dosis se muestra en color y la imagen de tomografía computarizada está en escala de grises. (Una versión en color de esta figura está disponible en https://doi.org/10.1016/j.ijrobp.2019.10.031.).
View Large Image | View Hi-Res Image | Download PowerPoint Slide
Inmediatamente después del tratamiento, la paciente fue entrevistada e informó sensaciones visuales similares a las descritas en la literatura.9 Ella afirmó que los destellos azules brillantes eran notables en 1 ojo (el ojo izquierdo, correspondiente a la lateralización del tratamiento) y eran persistentes independientemente de si sus párpados fueron abiertos o cerrados. El paciente declaró que estos destellos, percibidos como «rayas, chispas y puntitos azules», solo se notaron durante ciertas partes del tratamiento. Los puntos de tiempo correspondientes a los momentos en que el haz de radiación atravesaba el ojo se aislaron de la pila de imágenes. El Video 2 muestra contornos en tiempo real, acumulativos y planificados de este rango particular de puntos de tiempo. Las imágenes acumuladas obtenidas para este segmento de tiempo del tratamiento se muestran en la Figura 5A-5C. La emisión de Cherenkov del ojo es distinta; se encontró que la señal a ruido en la región de emisión de luz de la lente izquierda y la sien era 68 y 55, respectivamente, las intensidades medias de píxeles de las ROI se compararon con la desviación estándar de la señal de fondo.29 Siguiendo un método de cálculo similar a lo descrito anteriormente, la suma de fotones que salen del ROI de la lente fue de 2.5 × 103 fotones por 0.001 segundos durante la emisión máxima del ciclo ON del suministro pulsado.
Discusión
Al usar una cámara intensificada sincronizada con los pulsos de un acelerador lineal, pudimos capturar la emisión de luz de los ojos de una muestra de animales humanos y porcinos. Medimos los espectros de emisión en función de la profundidad en el ojo; la señal solo está presente cuando se irradia el líquido vítreo y se parece a la luz de Cherenkov. El espectro en la Figura 2A coincide con la dependencia conocida de λ «“ 2 para la luz de Cherenkov y está presente hasta que el haz esté detrás de la retina. La señal excesivamente ruidosa y poco confiable en el rango de 20 a 25 mm de profundidad de exploración, correspondiente a la irradiación fuera del volumen del ojo, confirma aún más esta observación. Las diferencias en los espectros de luz que salen del ojo, en comparación con la emisión de Cherenkov publicada anteriormente por los fantasmas (Fig. 2B), se pueden atribuir principalmente a las variaciones en las propiedades ópticas del tejido (es decir, los espectros de luz están altamente influenciados por propiedades específicas del tejido, como la dispersión y coeficientes de absorbancia) .30 Hemos observado que la luz de Cherenkov se produce de manera casi homogénea en todo el humor vítreo (Fig. 3) y se emite isotópicamente desde la pupila (Fig. 4). Estos datos son evidencia directa de que la emisión de luz de Cherenkov es al menos en parte un factor contribuyente en el proceso de generación de luz en el ojo durante la radioterapia. Sin embargo, aunque no se pueden descartar las teorías sobre la estimulación nerviosa directa, el centelleo de la lente y los fotones bioluminiscentes ultra débiles, parece claro que la producción de luz de Cherenkov en todo el ojo es cuantificable y significativa. Los fenómenos alternativos también pueden contribuir a la sensación de ver destellos de luz, pero son menos cuantificables a través de mediciones externas4,9,31.
Nuestra capacidad de capturar la emisión de Cherenkov del ojo fue posible por el hecho de que, a medida que la luz sale del ojo, se enfoca a través de la lente, prestándose bien a la imagen. Las muestras de ojos porcinos se eligieron estratégicamente porque la composición y las propiedades mecánicas del humor vítreo porcino se asemejan a las de los ojos humanos32,33. A su vez, los datos relacionados con los espectros ópticos y la intensidad de la señal son traducibles para los ojos humanos. Durante los escaneos de hojas, notamos que se detectó una señal de luz débil de la lente durante los períodos en que la hoja de radiación se encontraba fuera del ojo. Potencialmente, esto puede atribuirse a la radiación dispersa que ingresa al ojo y provoca la producción de luz de Cherenkov en el humor vítreo.
Las posibles aplicaciones de las imágenes de Cherenkov en la clínica de radioterapia se han descrito previamente.19,34,35 Por ejemplo, este tipo de imágenes permite la verificación de la geometría del campo de radiación, la detección potencial de errores inducidos por el movimiento durante el tratamiento e incluso la medición de la dosis superficial. .20,28,36,37 Debido a que es importante controlar la dosis en el ojo (el umbral para el daño inducido por la radiación, que puede ser significativo [p. Ej., Formación de cataratas], es bastante bajo), esta tecnología puede ser potencialmente de utilidad clínica importante , permitiendo la verificación de la dosis de tratamiento hacia o alrededor del ojo.38 Por lo tanto, existe la posibilidad de monitorear la geometría del campo en tiempo real y potencialmente identificar casos cuando la radiación de dispersión directa o excesiva golpea el ojo.
Estudios de revisión anteriores han indicado que la percepción del paciente de la luz de Cherenkov se puede mejorar cuando las condiciones de iluminación ambiental son tenues; Además, estos fenómenos visuales pueden suprimirse sustancialmente si el paciente está mirando directamente a una luz brillante. 13,39 El paciente presentado en este estudio fue tratado con solo luces de aplique iluminadas en la bóveda del acelerador lineal. Al igual que nuestro paciente, otros pacientes sometidos a radioterapia a menudo han informado que los destellos de luz son de color azul, de naturaleza similar a la chispa y se mueven a través de su rango de visión.11 Esto respalda nuevamente la idea de que la propagación de la luz de Cherenkov en el rango de longitud de onda de los colores azul verdosos contribuyen a la percepción visual de los destellos de luz9,12. Usando un modelo de producción de luz en el ojo durante la radioterapia, se ha demostrado que se generan 2,08 × 104 fotones de Cherenkov en 0,001 segundos durante la irradiación de 6 MV .13 Las diferencias en los resultados experimentales (8.13 × 103 y 2.5 × 103 en 0.001 segundos para datos ex vivo de animales y humanos in vivo, respectivamente) en comparación con estos cálculos del modelo pueden atribuirse a características experimentales específicas de la instalación, como la eficiencia de recolección de luz del Sistema de imagen y desviación de ángulo sólido de la luz que sale del ojo. No obstante, tanto los datos teóricos como los medidos muestran que la generación de luz de Cherenkov en el ojo supera el umbral para la percepción visual durante la radioterapia; El ojo humano requiere de 5 a 14 fotones que excitan la retina en 0.001 segundos en condiciones oscuras completas para provocar una sensación visual.
Clínicamente, el pronóstico visual del paciente depende de la dosis administrada a las estructuras anatómicas clave responsables de la visión. Como mínimo, la presencia de percepción de fosfeno por parte del paciente, o la luz de Cherenkov medida, puede confirmar que las estructuras oculares están recibiendo radiación. Sin embargo, aún se desconoce si esto se correlaciona con, o proporciona información adicional sobre, la pérdida visual independientemente de la dosis calculada. El trabajo adicional para correlacionar la luz de Cherenkov ocular registrada y la dosis administrada con resultados visuales a largo plazo puede ser relevante; estudios previos han demostrado que la falta de percepción de fosfeno predice la pérdida de visión después de la irradiación terapéutica.9 La cuantificación de la dosis de radiación también puede ser una aplicación útil de esta tecnología. Otro punto clínico es que se puede proporcionar una explicación válida del mecanismo de fosfeno al paciente que puede aliviar la ansiedad durante el tratamiento.
Conclusiones
Hemos demostrado que cuando la radiación ionizante incide sobre el ojo, la luz producida aparece dominada por la emisión de Cherenkov, como lo identifica el espectro, y una emisión que es fácilmente detectable a través de la pupila. Cuando se usó un haz delgado para emitir imágenes desde un ojo ex vivo, se detectó la emisión máxima de luz a aproximadamente 10 mm de profundidad, pero se observó un espectro e intensidad similares a los de Cherenkov desde la córnea hasta la retina. La luz observada desde la pupila disminuye si no se irradia fluido vítreo. El seguimiento cuantitativo de la irradiación al ojo parece posible desde una variedad de ángulos, utilizando imágenes sincronizadas en el tiempo de la emisión. Esta técnica para estudiar y rastrear el fenómeno de la generación de luz en el ojo funciona durante la radioterapia estereotáctica estándar, en tiempo real y sin interrumpir el flujo de trabajo clínico.
Dato suplementario
Emisión de luz de un ojo de cerdo enucleado, ya que se irradia con láminas de radiación desde varias direcciones y ángulos de pórtico
Cherenkov en tiempo real, Cherenkov acumulativo y contornos de planificación del tratamiento para un paciente sometido a radiocirugía estereotáctica. La barra de colores para Cherenkov acumulativo es la misma que se muestra en la Figura 5A-5C.
Referencias
1. Reznikov, IuE. [Mechanophosphene in optic nerve changes]. Oftalmol Zh. 1981; 36: 218″“220
2. Lindenblatt, G. and Silny, J. Electrical phosphenes: On the influence of conductivity inhomogeneities and small-scale structures of the orbita on the current density threshold of excitation. Med Biol Eng Comput. 2002; 40: 354″“359
3. Merabet, L.B., Theoret, H., and Pascual-Leone, A. Transcranial magnetic stimulation as an investigative tool in the study of visual function. Optom Vis Sci. 2003; 80: 356″“368
4. Bókkon, I. Phosphene phenomenon: A new concept. Biosystems. 2008; 92: 168″“174
5. Fazio, G.G., Jelley, J.V., and Charman, W.N. Generation of Cherenkov light flashes by cosmic radiation within the eyes of the Apollo astronauts. Nature. 1970; 228: 260″“264
6. Tobias, C.A., Budinger, T.F., and Lyman, J.T. Radiation-induced light flashes observed by human subjects in fast neutron, x-ray and positive pion beams. Nature. 1971; 230: 596″“598
7. Narici, L., De Martino, A., Brunetti, V. et al. Radicals excess in the retina: A model for light flashes in space. Radiat Meas. 2009; 44: 203″“205
8. McNulty, P.J., Pease, V.P., and Bond, V.P. Role of Cerenkov radiation in the eye-flashes observed by Apollo astronauts. Life Sci Space Res. 1976; 14: 205″“217
9. Mathis, T., Vignot, S., Leal, C. et al. Mechanisms of phosphenes in irradiated patients. Oncotarget. 2017; 8: 64579″“64590
10. Thariat, J., Leal, C., d’Ascoli, A. et al. Phosphenes in patients receiving radiotherapy. Lancet Oncol. 2016; 17: 869″“871
11. Lipetz, L.E. The x-ray and radium phosphenes. Br J Ophthalmol. 1955; 39: 577″“598
12. Steidley, K.D., Eastman, R.M., and Stabile, R.J. Observations of visual sensations produced by Cerenkov radiation from high-energy electrons. Int J Radiat Oncol Biol Phys. 1989; 17: 685″“690
13. Newman, F., Asadi-Zeydabadi, M., Durairaj, V.D. et al. Visual sensations during megavoltage radiotherapy to the orbit attributable to Cherenkov radiation. Med Phys. 2008; 35: 77″“80
14. Chen, J.D., Gerwing, A.F., and Lewis, P.D. Long-cooled spent fuel verification using a digital Cerenkov viewing device. INIS. 2001; 33
15. Ong, R.A., Bhattacharya, D., Covault, C.E. et al. Detection of atmospheric Cherenkov radiation using solar heliostat mirrors. Astropart Phys. 1996; 5: 353″“365
16. Casolino, M. Observations of the light flash phenomenon in space. Adv Space Res. 2006; 38: 1177″“1181
17. Ashraf, M.R., Bruza, P., Krishnaswamy, V., Gladstone, D.J., and Pogue, B.W. Technical Note: Time-gating to medical linear accelerator pulses: Stray radiation detector. Med Phys. 2019; 46: 1044″“1048
18. Bruza, P., Gollub, S.L., Andreozzi, J.M. et al. Time-gated Scintillator Imaging for Real-time Optical Surface Dosimetry in Total Skin Electron Therapy. Phys Med Biol. 2018; 63: 095009
19. Tendler, I., Brůža, P., Andreozz, J. et al. Rapid Multi-Site Remote Surface Dosimetry for Total Skin Electron Therapy: Scintillator Target Imaging. (https://doi.org/10.1016/j.ijrobp.2018.10.030)Int J Radiat Oncol. 2018;
20. Tendler, I.I., Bruza, P., Jermyn, M. et al. Characterization of a non-contact imaging scintillator-based dosimetry system for total skin electron therapy. Phys Med Biol. 2019; 64: 125025
21. Andreozzi, J.M., Brůža, P., Tendler, I.I. et al. Improving treatment geometries in total skin electron therapy: Experimental investigation of linac angles and floor scatter dose contributions using Cherenkov imaging. Med Phys. 2018; 45: 2639″“2646
22. Tendler, I.I., Bruza, P., Jermyn, M. et al. Improvements to an optical scintillator imaging-based tissue dosimetry system. J Biomed Opt. 2019; 24: 1″“6
23. Automated wavelength and intensity calibration routines significantly improve accuracy of recorded spectra. 1-8 (Princeton Instruments). Available at: https://www.princetoninstruments.com/userfiles/files/technotes/IntelliCal-Automated-wavelength-and-intensity-calibration-routines-A0.pdf Accessed December 6th, 2019.
24. Heilbrun, M.P., Roberts, T.S., Apuzzo, M.L. et al. Preliminary experience with Brown-Roberts-Wells (BRW) computerized tomography stereotaxic guidance system. J Neurosurg. 1983; 59: 217″“222
25. Glaser, A.K., Zhang, R., Davis, S.C., Gladstone, D.J., and Pogue, B.W. Time-gated Cherenkov emission spectroscopy from linear accelerator irradiation of tissue phantoms. Opt Lett. 2012; 37: 1193″“1195
26. Dsouza, A., Lin, H., Gunn, J.R. et al. Cherenkov-excited multi-fluorophore sensing in tissue-simulating phantoms and in vivo from external beam radiotherapy. Radiat Res. 2018; 189: 197″“204
27. Glaser, A.K., Zhang, R., Andreozzi, J.M., Gladstone, D.J., and Pogue, B.W. Cherenkov radiation fluence estimates in tissue for molecular imaging and therapy applications. Phys Med Biol. 2015; 60: 6701″“6718
28. Alexander, D.A., Tendler, I.I., Bruza, P. et al. Assessment of imaging Cherenkov and scintillation signals in head and neck radiotherapy. Phys Med Biol. 2019; 64: 145021
29. Anthony Seibert, J. and Bushberg, Jerrold T. The Essential Physics of Medical Imaging. Wolters Kluwer Health/Lippincott Williams & Wilkins, Philadelphia, PA; 2012
30. Jacques, S.L. Optical properties of biological tissues: A review. Phys Med Biol. 2013; 58: R37″“R61
31. Fuglesang, C. Using the human eye to image space radiation or the history and status of the light flash phenomena. Nucl Instrum Methods Phys Res Sect Accel Spectrometers Detect Assoc Equip. 2007; 580: 861″“865
32. Swindle, K., Hamilton, P., and Ravi, N. In situ formation of hydrogels as vitreous substitutes: Viscoelastic comparison to porcine vitreous. (Available at:)
https://onlinelibrary.wiley.com/doi/epdf/10.1002/jbm.a.31769
Date accessed: June 10, 2019
33. Sanchez, I., Martin, R., Ussa, F. et al. The parameters of the porcine eyeball. Graefes Arch Clin Exp Ophthalmol. 2011; 249: 475″“482
34. Hachadorian, R., Bruza, P., Jermyn, M. et al. Correcting Cherenkov light attenuation in tissue using spatial frequency domain imaging for quantitative surface dosimetry during whole breast radiation therapy. J Biomed Opt. 2018; 24: 1″“10
35. Tendler, I., Bruza, P., Hachadorian, R.L. et al. Scintillator Target Imaging: A Novel Surface Dosimetry Method. Int J Radiat Oncol. 2019; 105: E697″“E698
36. Zhang, R., Andreozzi, J.M., Gladstone, D.J. et al. Cherenkoscopy based patient positioning validation and movement tracking during post-lumpectomy whole breast radiation therapy. Phys Med Biol. 2014; 60: L1″“L14
37. Jarvis, L.A., Zhang, R., Gladstone, D.J. et al. Cherenkov Video Imaging Allows for the First Visualization of Radiation Therapy in Real Time. Int J Radiat Oncol. 2014; 89: 615″“622
38. Thome, C., Chambers, D.B., Hooker, A.M. et al. Deterministic effects to the lens of the eye following ionizing radiation exposure: Is there evidence to support a reduction in threshold dose?. Health Phys. 2018; 114: 328″“343
39. de Kruijf, W., Timmers, A., Dekker, J. et al. Occurrence and mechanism of visual phosphenes in external photon beam radiation therapy and how to influence them. Radiother Oncol. 2019; 132: 109″“113
40. Hecht, S., Shlaer, S., and Pirenne, M.H. Energy, quanta, and vision. J Gen Physiol. 1942; 25: 819″“840
https://www.redjournal.org/article/S0360-3016(19)33947-1/fulltext